Elektrische Herzkrankheiten
Die Informationen auf dieser Seite finden Sie in Band 25 einer eBook-Reihe der Patienten-Akademie.
Hier bekommen Sie dieses eBook in verschiedenen Formaten:
- padBook (für iPad und epub3-fähige eBook-Reader)
- phoneBook (für smartPhones)
- Paperwhite (für Kindle Paperwhite)
Leseprobe
Elektrische Herzerkrankungen
Arrhythmogene rechtsventrikuläre Dysplasie (ARVD
Beschreibung der Erkrankung
.png) |
| Abb.1 |
| Desmosomen |
| Erklärungen siehe Text |
Man bezeichnet diese Krankheit auch als arrhythmogene rechtsventrikuläre Cardiomyopathie (ARVC). Übersetzt bedeutet dies: „Arrhythmogen“ = kann Rhythmusstörungen auslösen, „rechtsventrikuläre“ = den rechten Ventrikel betreffend, „Dysplasie“ = fehlerhafte Struktur (oder „Cardiomyopathie“ = Herzmuskelkrankheit).
Primär betroffen sind von dieser Erkrankung die Desmosomen (Abb.1).
Desmosome sind spezielle Verbindungsstrukturen zwischen 2 benachbarten Zellen.
Sie kommen häufig in Zellen vor, die besonders stark mechanisch belastet sind, z.B. den Haut- und den Herzmuskelzellen. Sie bestehen aus sog. Plaques, die sich auf den Innenseiten der Zellmembranen benachbarter Zellen befinden.
Diese plattenförmgen Plaques bestehen aus einem speziellen Eiweiß, dem Desmoplakin. In diesen Plaques sind feine Fäden aus einem Einweiß namens Desmin verankert, die durch die gesamte Zelle ziehen und dabei auch mit den Aktin-Myosin-Elementen verbunden sind, die für das Zusammenziehen der Muskelzelle verantwortlich sind.
Durch diese Fäden werden die Plaques an bestimmten Stellen auf der Zelloberfläche fixiert.
Im Inneren einer Zelle existieren zusätzliche Fäden, die durch den Plaque hindurch in den Raum zwischen den Zellen ziehen (mehrere chemisch unterschiedliche Cadherine). Hier verbinden sie sich mit den Cadherinfäden der anderen Zelle, sodaß eine feste Verbindung zwischen beiden Zellen entsteht.
Gleichzeitig spielen die Desmosomen aber auch eine Rolle bei der elektrischen Verbindung der beiden Zellen, indem sie elektrische Impulse von der einen zur anderen Zelle übertragen können.
Bei der arrhythmogenen rechtsventrikulären Dysplasie kommt es infolge eines Fehlers einzelner Teile der Erbsubstanz (Gene) zu einer Störung im Aufbau der Desmosome. Dies hat zur Folge, daß einzelne Zellen vor allem unter Belastung nicht mehr fest miteinander verbunden sind und das Herzgefüge gelockert wird.
Weil die Desmosome aber u.a. auch für die Übertragung elektrischer Impulse von Zelle zu Zelle wichtig sind kommt es, wenn die Zellverbindungen gestört sind, auch zu elektrischen Störungen des Herzens.
Bei der ARVD handelt es sich daher um eine kombinierte Störung der Herzmuskelfunktion, indem eine fortschreitende Müdigkeit des von der Krankheit betroffenen Herzmuskels eintritt, und dem Auftreten von Herzrhythmusstörungen.
Die Auswirkungen einer solchen Störung des Desmosomen-Struktur drückt sich neben den o.g. Auswirkungen auch darin aus, daß in dem betroffene Herzmuskel zunehmend fetthaltigem Gewebe entsteht, das den Herzmuskel durchsetzt und verdrängt, sodaß er schleichend zunehmend von diesem Fettgewebe ersetzt wird. Auch dieser Verlust an Herzmuskelzellen hat natürlich Auswirkungen auf die Pumpfunktion und die Größe der betroffenen Herzkammer.
Betroffen ist üblicherweise der Herzmuskel des rechten Ventrikels, ein Befall des Muskels des linken Ventrikels oder beider Hauptkammern ist aber ebenfalls möglich.
Die Erkrankung kann vererbt werden, wobei der Erbgang wechselhaft ist und sich die genetischen Auswirkungen nicht auf jeden betroffenen Menschen auswirken. Daher kann man innerhalb einer Familie nicht vorhersagen, bei wem die Krankheit ausbrechen wird und bei wem nicht.
⅔ aller Menschen, bei denen die Krankheit nachgewesen wurde zeigen bei einer genetischen Untersuchung Auffälligkeiten. Die Erkrankung betrifft in Europa etwa 1 auf 2.000 - 5.000 Menschen.
Es gibt verschiedene Ausdrucksformen der ARVD, je nachdem, welches Gen betroffen ist und welche Auswirkungen dies hat. Diese Unterschiede betreffen aber nicht die Möglichkeit schwerer Rhythmusstörungen, sondern vielmehr evtl. Begleiterscheinungen der Krankheit (z.B. vermehrte Hornhautbildung an den Handflächen oder eine wollarige Beschaffenheit der Kopfhaare).
Die gefürchtete Komplikation der Erkrankung ist der plötzliche Herztod. Daher ist es wichtig, Menschen schon sehr früh und n.M. vor dem Auftreten der gefürchteten Herzrhythmusstörung zu erkennen.
Grundsätzlich ist die ARVD eine Erkrankung, die die Struktur des Herzens betrifft. Daher müssen dafür, daß die Diagnose gestellt werden darf, bestimmte Voraussetzungen erfüllt sein, die zeigen, daß die Funktion des betroffenen Herzmuskels beeinträchtigt ist oder daß die Herzmuskulatur von Fettgewebe durchsetzt ist. Im Abschnitt über die Untersuchungsmethoden gehe ich auf diese Kriterien genauer ein.
Eine andere diagnostische Voraussetzung ist der Nachweis einer bösartigen Herzrhythmusstörung namens „ventrikuläre Tachykardie“, die zu einer teilweise massiven Beschleunigung des Herzschlages führt.
Ventrikuläre Tachykardien bei dieser Erkrankung treten meistens unter körperlicher Belastung auf.
Krankheitserscheinungen
Die Auswirkungen der Krankheit auf den Herzmuskel und seine Pumpfunktion verlaufen schleichend, sodaß die Betroffenen zu Beginn zunächst keine Beschwerden haben.
Bei den Beschwerden muß man unterscheiden zwischen den „elektrischen“ Auswirkungen und den Auswirkungen auf den Herzmuskel.
- Elektrische Auswirkungen: Typischerweise wird eine ARVD im Alter von 20 - 40 Jahren festgestellt.
In den frühen Stadien der Erkrankungen bemerken die meisten Patienten Herzstolpern, das durch Herzrhythmusstörungen verursacht wird und das vor allem unter körperlicher Belastung auftritt. Dies betrifft etwa 30- 60% aller Erkrankten. Bei jeweils etwa ⅕ aller Patienten sind allerdings Schwindel und Ohnmachtsanfälle die 1. Symptome. Auch sie werden durch die Herzrhythmusstörungen verursacht. Dabei ist bei ca. 20% aller Patienten ein Herzstillstand das 1. Anzeichen für die Krankheit ist, ohne daß es vorher Warnsymptome gegeben hätte.
Bei etwa 60% aller Betroffenen ist es eine schnelle Herzrhythmusstörung (ventrikuläre Tachykardie), die nicht zum Herzstillstand führt, aber die Anlaß für eine 1. ärztliche Kontaktaufnahme ist. Auch andere Herzrhythmusstörungen wie gehäuft auftretende einzelne ventrikuläre Extrasystolen oder Vorhofflimmern können in den Frühstadien der Erkrankung auftreten.
- Auswirkungen auf den Herzmuskel: Neben den o.g. Herzrhythmusstörungen hat die Erkrankung in ihrem Verlauf bei etwa der Hälfte aller Patienten Auswirkungen auf die Pumpkraft des Herzens, die sich vor allem in Luftnot unter Belastung zeigt. Diese Pumpschwäche des Herzens schreitet oft weiter fort und ist in den fortgeschrittenen Fällen der Grund für eine Herztransplantation.
Untersuchungsmethoden
Erfragen der Familien-Vorgeschichte
Weil die ARVD eine Erbkrankheit ist besteht zu etwa 50% die Möglichkeit, daß auch Blutsverwandte der Betroffenen erkrankt sind. Es ist daher wichtig zu erfahren, ob auch Familienangehörige erkrankt sind.
Wenn in der Familie Menschen sind, die plötzlich und noch in jungen Jahren verstorben sind oder wenn es Menschen gibt, die ebenfalls schon in jungen Jahren Symptome einer Herzschwäche haben dann besteht der Verdacht darauf, daß sie ebenfalls an der ARVD leiden und die Erkrankung an eine oder einen Nachfahren weitergegeben haben. Diese Familienangehörigen sollten sich unbedingt in einem kardiologischen Zentrum vorstellen, um sich dort auf eine evtl. vorliegenden ARVD untersuchen zu lassen.
Körperliche Untersuchung
Bei der körperlichen Untersuchung findet man in den Frühstadien der Erkrankung in aller Regel keine Auffälligkeiten. Erst wenn in fortgeschrittenen Krankheitsstadien eine Herzschwäche auftritt kann man krankhafte Untersuchungsbefunde feststellen.
Diese unterscheiden sich in Abhängigkeit davon, ob die rechte, die linke oder beide Herzkammern betroffen sind, wobei die Befunde bei einer Schwäche des rechten Herzens (Wassereinlagerungen in die Beine, vergrößerte Leber) am häufigsten anzutreffen sind.
Die Auswirkungen einer Schwäche des linken Ventrikels (mit dem Stethoskop hörbare Wasseransammlungen in den Lungen) sind dagegen nur selten zu finden.
Bei einer besonderen Form der ARVD (Naxos-Erkrankung), bei der eine besondere genetische Fehlbildung der Desmosomen vorliegt, kann man eine verstärkte Verhornung der Haut der Handflächen und Fußsohlen finden und das Kopfhaar ist dick und wollartig.
Geräusch
Herzgeräusche treten nicht auf.
EKG
Siehe auch eBook über EKG-Untersuchungen und eBook über Herzrhythmusstörungen.
 |
| Abb.2 |
| Negative T-Wellen |
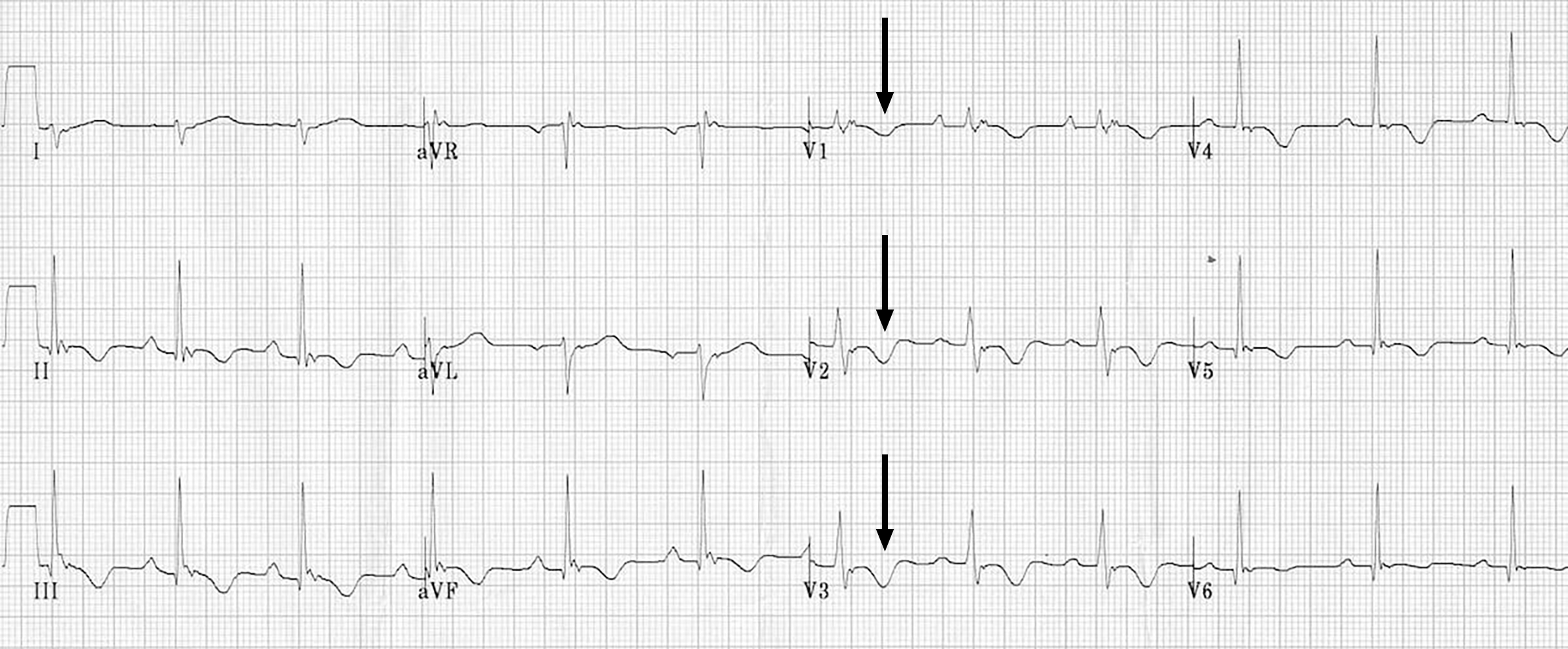
Das EKG bei Patienten mit ARVD ist nur ganz selten normal.
Am häufigsten findet man negative T-Wellen in den Brustwandableitungen V1 - V3 (Abb. 2).
 |
| Abb.3 |
| epsilon-Welle |
Wenn, wie in Abb. 2, auch die Abl. V5 und V6 negativ sind, kann man vermuten, daß nicht nur der Herzmuskel des rechten, sondern auch derjenige des linken Ventrikel betroffen ist.
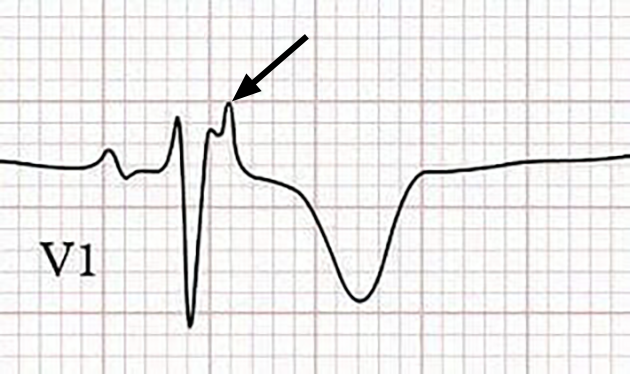
Ein 2. häufig anzutreffender Befund ist die sog. Epsilon-Welle (Abb. 3), die in etwa der Hälfte aller Fälle mit ARVD zu sehen ist.
Dabei handelt es sich um eine kleine Zacke am Ende des Kammer- (QRS-) Komplexes in Abl. V1 und evtl. V2.
Sie entsteht durch eine verzögerte Aktivierung der Herzmuskelzellen des rechten Ventrikels.
 |
| Abb.4 |
| Ventrikuläre Tachykardie |
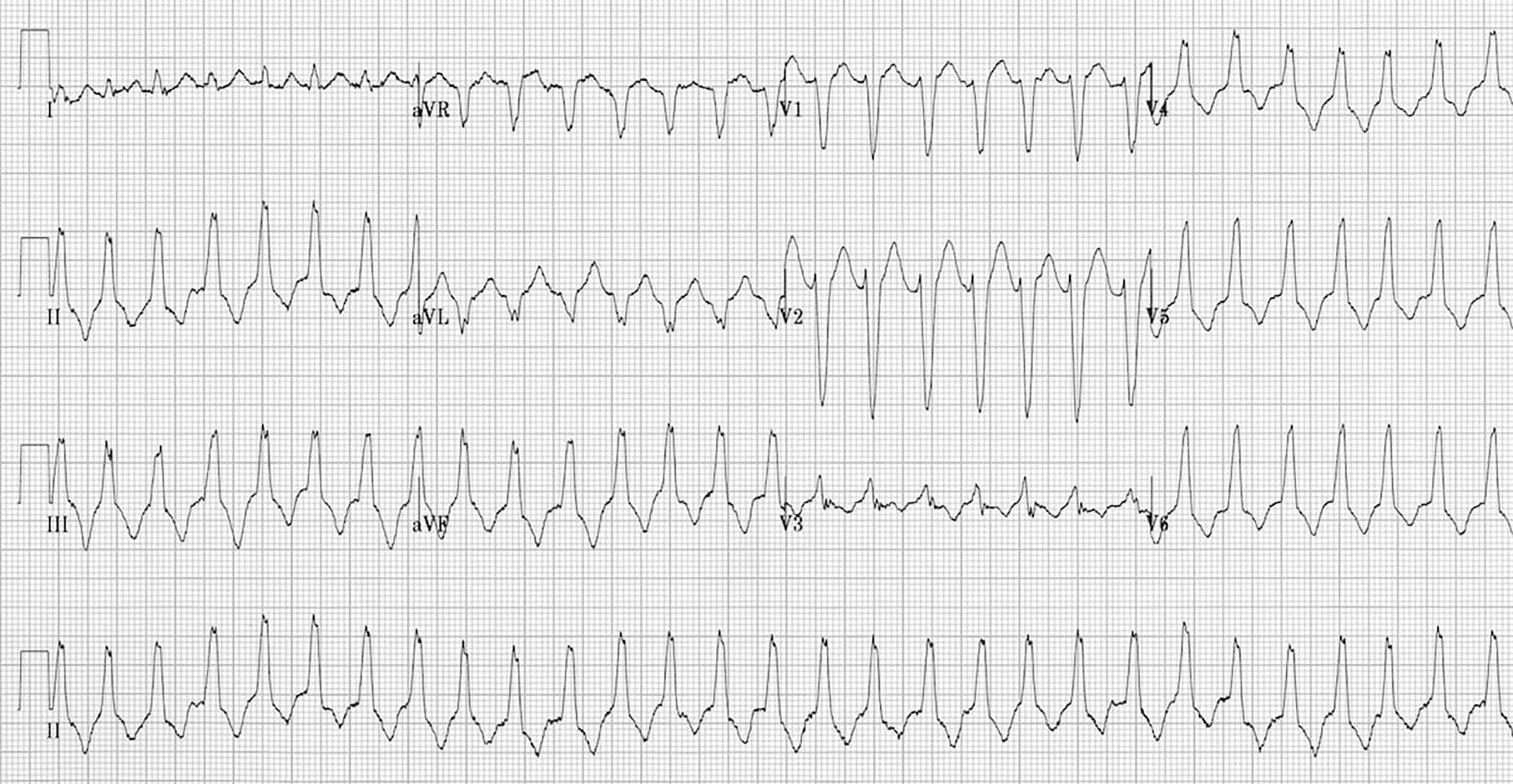
Ein weiterer Befund im EKG ist eine schnelle und bösartige Herzrhythmusstörung, die ventrikuläre Tachykardie (Abb. 4).
Man sieht eine ventrikuläre Tachykardie allerdings nicht, wie die negativen T-Wellen und die Epsilon-Wellen, in einem normalen EKG, sondern nur dann, denn sich ein Patient mit Herzrasen oder Schwindel beim Arzt vorstellt. Meistens treten diese Rhythmusstörungen durch körperliche Belastungen ausgelöst. Aus einer solchen ventrikulären Tachykardie kann sich sehr schnell tödliches Kammerflimmern entwickeln, weshalb der Nachweis dieser Rhythmusstörung als Notfall anzusehen ist.
Ventrikuläre Tachykardien stammen beim ARVD meistens aus dem rechten Ventrikel, was ein geübter Kardiologe aus dem EKG ersehen kann.
Langzeit-EKG
Für genauere Infos über diese Untersuchung hier klicken.
 |
| Abb.5 |
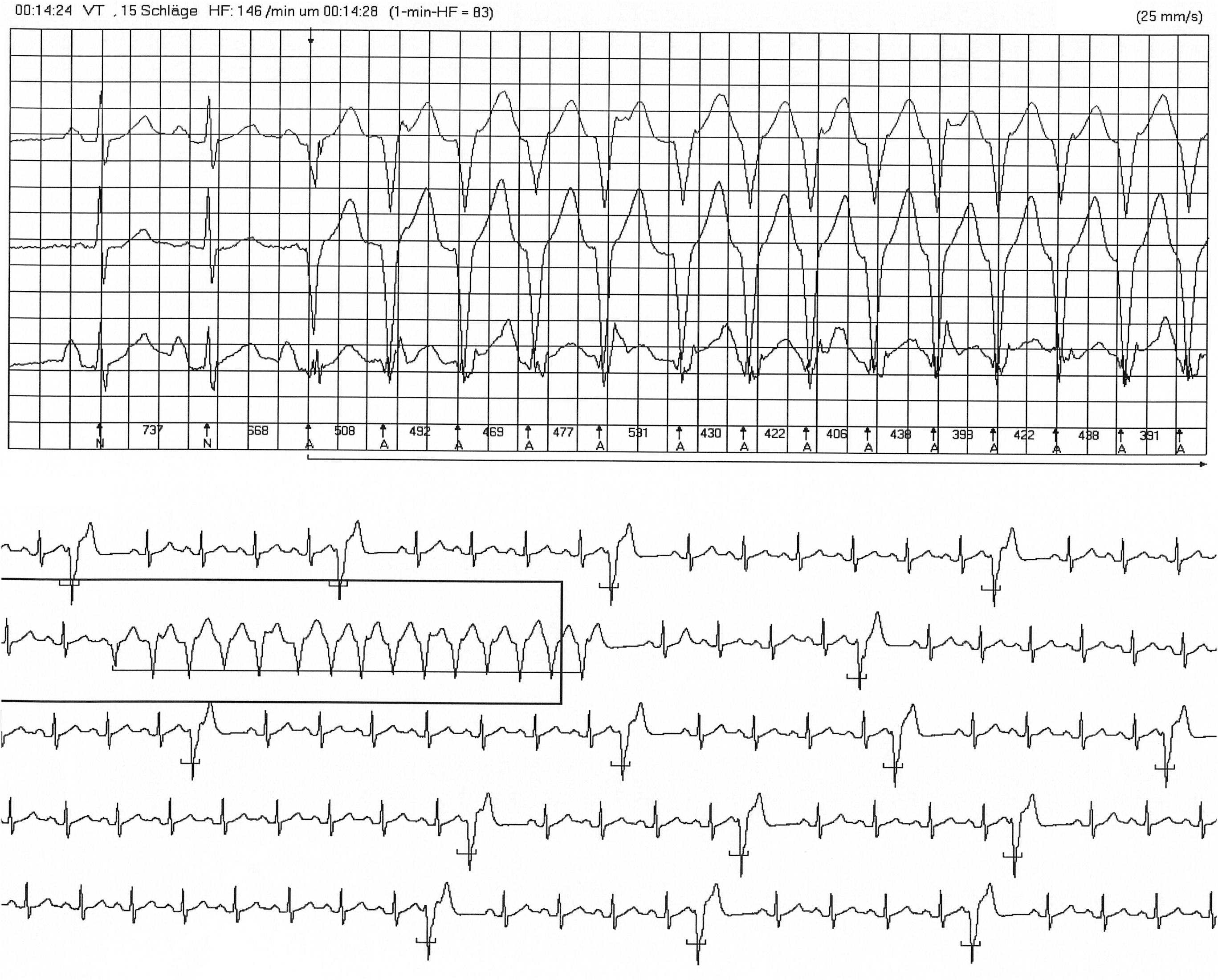
Mit dem Langzeit-EKG sucht man, vor allem bei Patienten, die über Herzklopfen klagen, nach Herzrhythmusstörungen.
Im Langzeit-EKG kann man diese Rhythmusstörungen dann genau zuordnen.
In nicht wenigen Fällen findet man mit dieser Untersuchung auch kurze Episoden mit ventrikulären Tachykardien (Abb. 5).
Röntgen
Für genauere Infos zum Röntgen hier klicken.
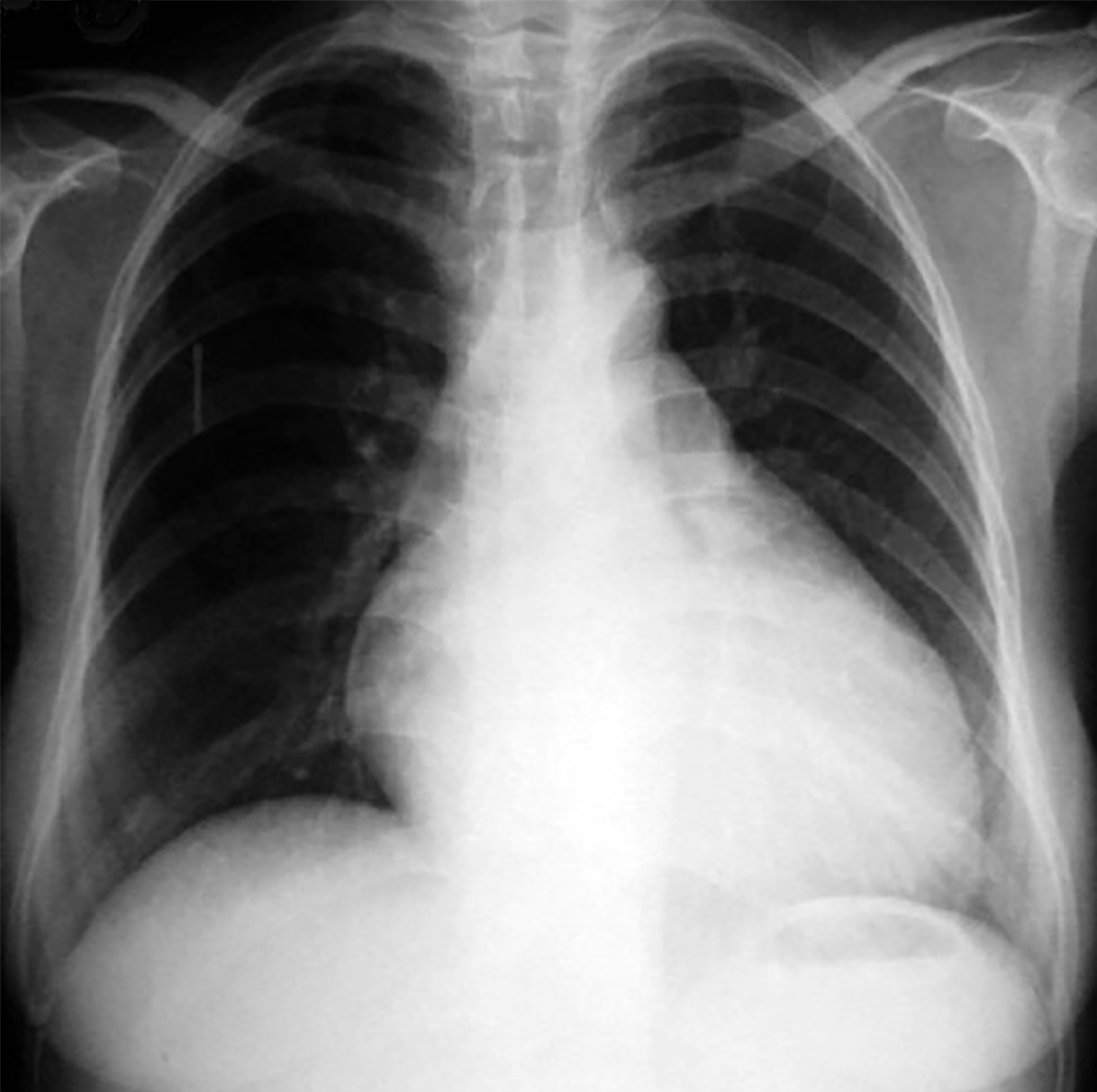 |
| Abb.6 |
| Röntgenbild bei ARVD mit vergrößertem Herzen als Ausdruck einer Pumpschwäche der linken Hauptkammer |
In den frühen Stadien der Erkrankung zeigt das Röntgenbild keine Auffälligkeiten. Diese treten erst dann in Erscheinung, wenn die Erkrankung den Herzmuskel derartig in Mitleidenschaft gezogen hat, daß es zu einer Pumpschwäche des Herzens kommt (Abb. 6).
Echokardiographie
Für genauere Infos über diese Untersuchung hier klicken.
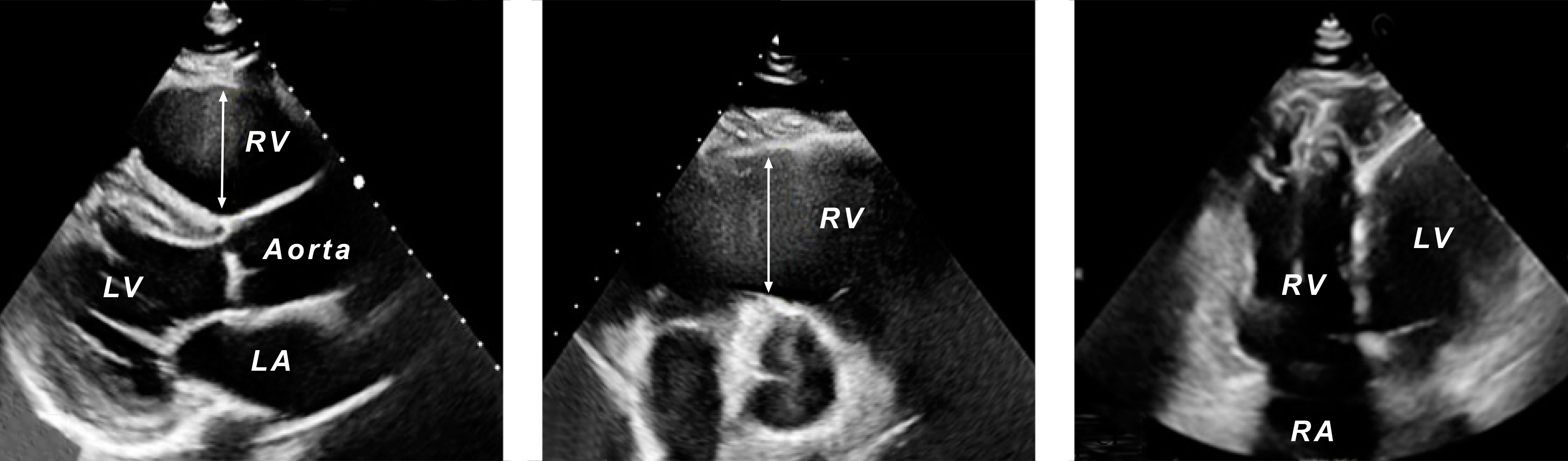 |
| Abb.6 |
| RV = rechter Ventrikel, LV = linker Ventrikel, RA = rechter Vorhof |
In der Ultraschalluntersuchung des Herzens sieht man einen vergrößerten rechten Ventrikel (Abb. 7).
In vielen Fällen sieht man auch eine Müdigkeit der Pumpaktionen des rechten Ventrikels wie in Film 1.
| Film 1 |
Dabei kann man oft (siehe in Film 1) eine verstärkte „Trabekularisierung“ des rechten Ventrikels vor allem in seinen spitzennahen Anteilen sehen. „Trabekel“ sind Bälkchen des Herzmuskels (Abb. 8).
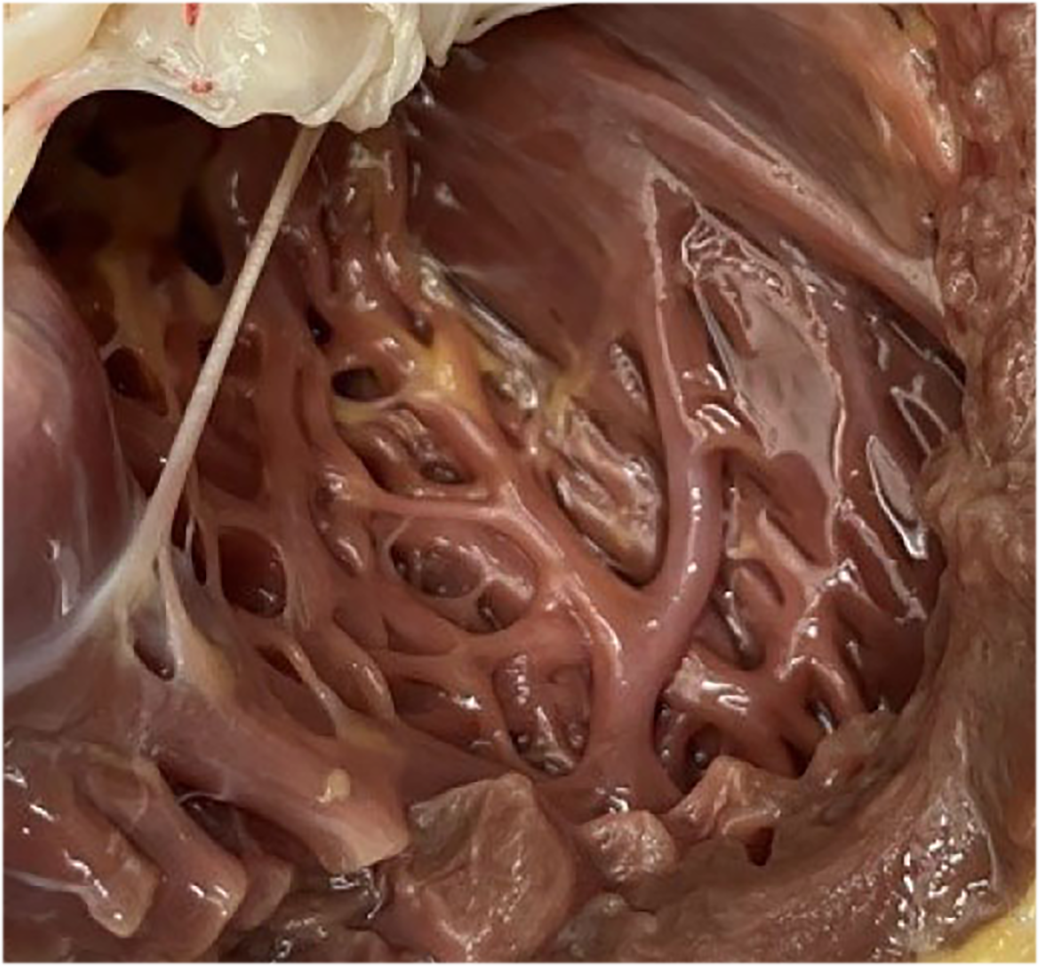 |
| Abb.8 |
| Trabekel (Muskelbälkchen), hier im linken Ventrikel |
Kardio-CT und MRT
Für genauere Infos über das MRT hier klicken.
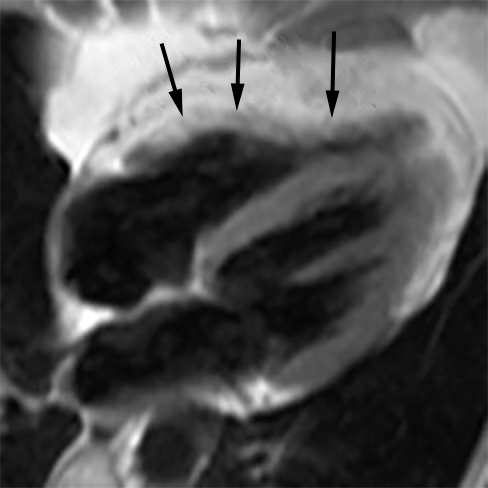 |
| Abb.9 |
ARVD im MRT. Den vermehrten Fettgehalt der Wand des rechten Ventrikels erkennt man an seiner weißlichen Färbung (Pfeile). |
Das MRT ist die bevorzugte Untersuchungsmethode bei einer ARVD.
Mit einer bestimmten Einstellung des Gerätes kann man die Durchsetzung des Herzmuskels mit fetthaltigem Gewebe gut erkennen (Abb. 9).
 |
| Abb.10 |
| Verstärkte Trabekularisierung (Pfeil) der Spitzenregion des rechten Ventrikels bei ARVD |
Auch sieht man im MRT die vermehrte Trabekularisierung des rechten Ventrikels (Abb. 10).
Mit Hilfe des MRT kann man auch die eingeschränkten Pumpbewegungen der Wand des rechten Ventrikels sehen und das (vergrößerte) Volumen des Ventrikels messen.
Wenn, aus welchem Grund auch immer, ein MRT nicht durchführbar ist kann man auch ein Kardio-CT anwenden, das aber die fetthaltige Durchsetzung des Muskelgewebes nicht darstellen kann.
Herzkatheter
Für genauere Informationen über eine Rechtsherzkatheteruntersuchung hier klicken.
Herzkatheteruntersuchungen werden nur selten durchgeführt und zwar meistens dann, wenn eine ARVD wegen des vergrößerten rechten Ventrikels gegen einen angeborenen Herzfehler mit Links-rechts-Shunt abgewogen werden muß.
Wenn man über einen Rechtsherzkatheter Kontrastmittel in den rechten Ventrikel einspritzt sieht man dessen Vergrößerung und müden Pumpbewegungen (Film 2).
| Film 2 |
| Einspritzung von Kontrastmittel über einen Katheter, der über die untere Hohlvene in den rechten Ventrikel eingeführt wurde. |
| Das Kontrastmittel fließt über die Lungenschlagader ab. |
Auch die Trabekularisierung ist gut zu erkennen.
Elektrophysiologische Untersuchung (EPU)
Für genauere Infos über diese Untersuchung hier klicken.
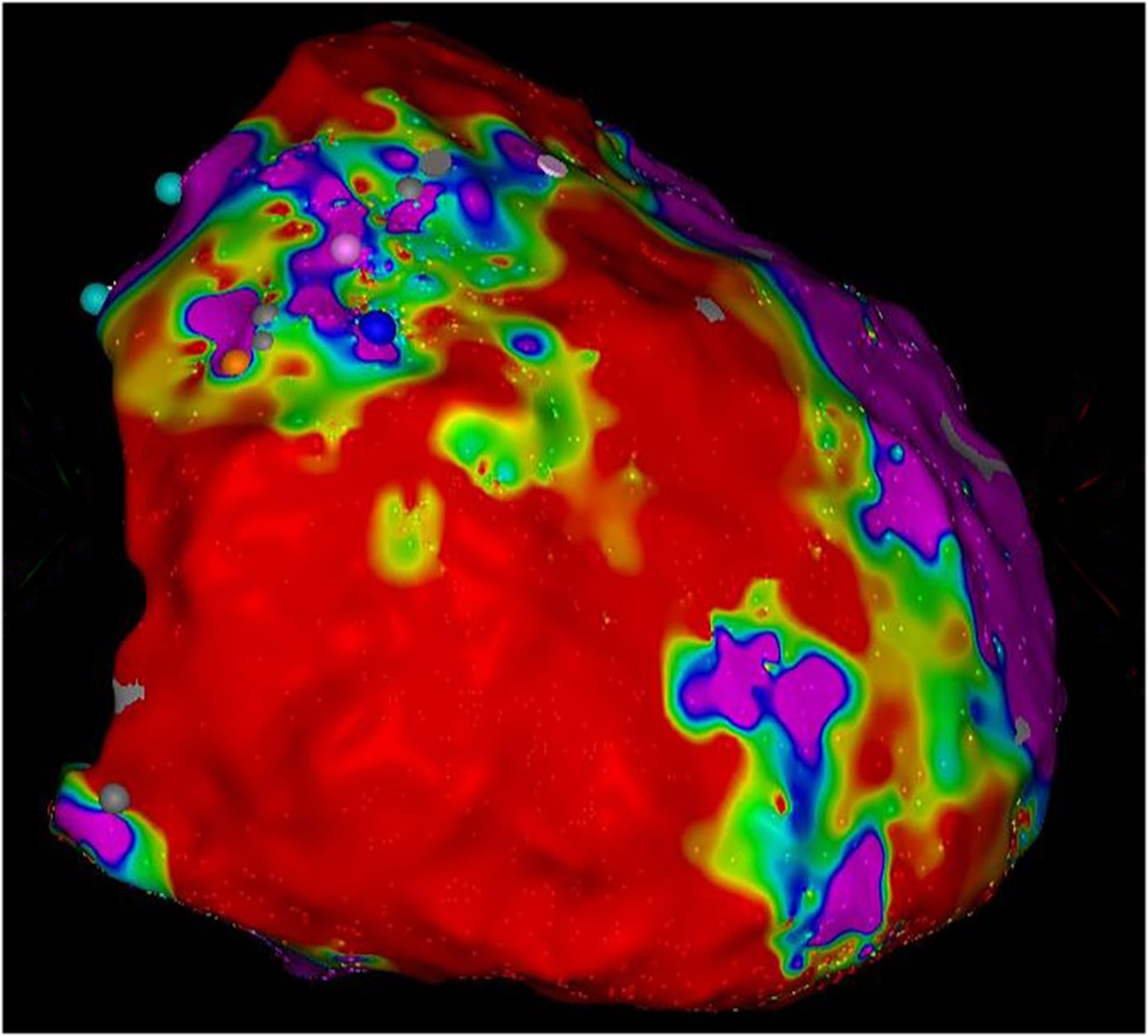 |
| Abb.11 |
| Rechter Ventrikel |
| blau = gesunder Herzmuskel rot = vernarbter Muskel |
Bei dieser Untersuchung tastet man das Innere einer Herzkatheter mit speziellen Kathetern ab und kann dann den Lauf der elektrischen Erregung graphisch darstellen. Durch verschiedene Farbabstufungen kann man so gesundes und krankes narbiges Gewebe sichtbar machen und der Ursprung von Herzrhythmusstörungen millimetergenau lokalisieren (Abb. 11).
n den bewegten Bildern einer solchen Untersuchung (hier nicht dargestellt) sieht man, daß die elektrischen Signale im gesunden Herzgewebe normal weitergeleitet, im kranken Gewebe aber nicht geleitet werden. Hierdurch kann es zu Erregungen kommen, die um eine Narbe herum „kreisen“, sodaß bestimmte Herzrhythmusstörungen (z.B. ventrikuläre Tachykardien) entstehen.
Durch die Gabe bestimmter Medikamente (z.B. Adrenalin) oder durch die Abgabe von zusätzlichen elektrischen Impulsen (programmierte Stimulation) können z.B. ventrikuläre Tachykardien ausgelöst ausgelöst werden und gegen andere Rhythmusstörungen abgegrenzt werden.
Herzmuskelbiopsie
Für genauere Infos zu dieser Untersuchung hier klicken.
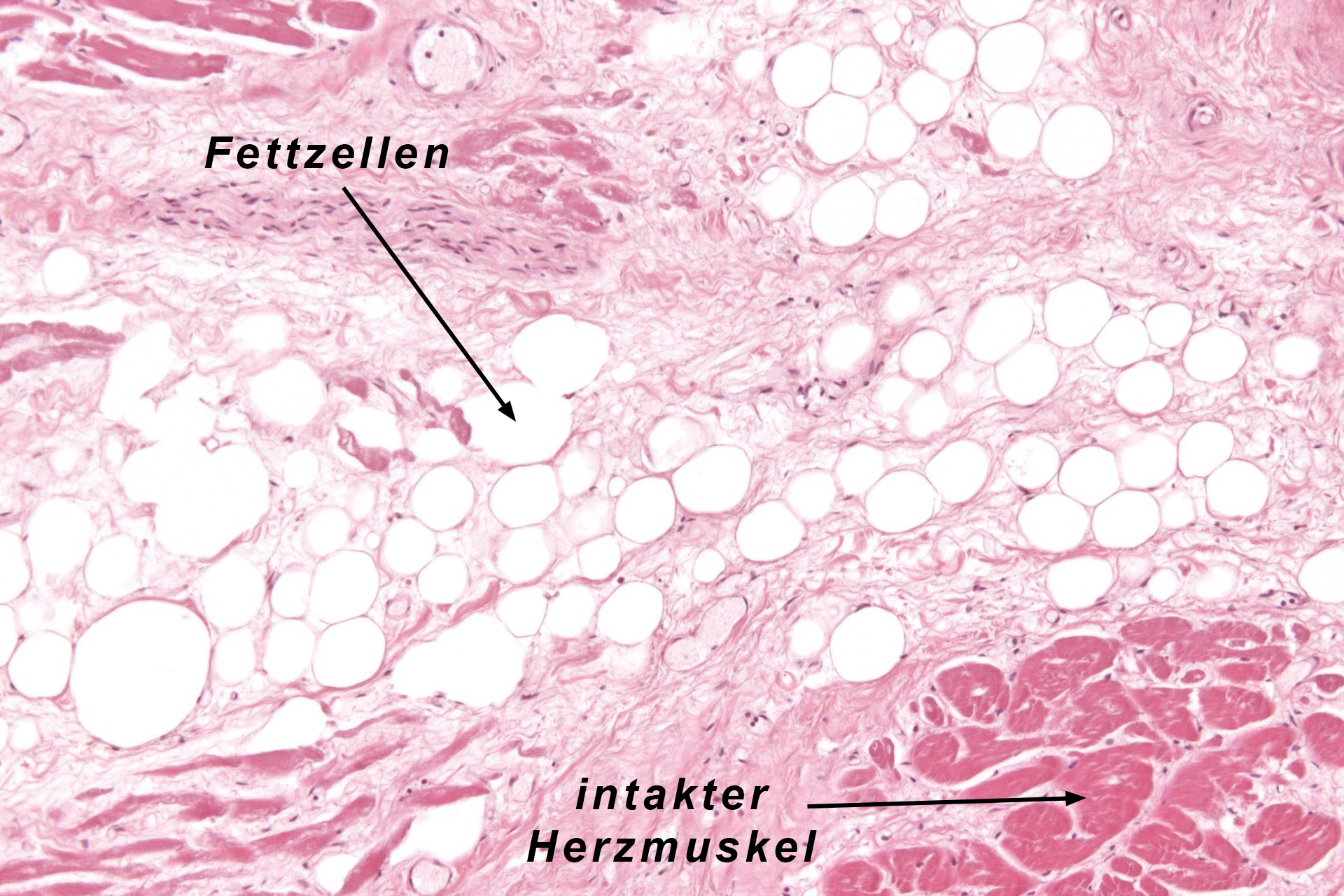 |
| Abb.12 |
In bestimmten Fällen kann man eine mikroskopische Untersuchung des erkrankten Herzmuskels durchführen, z.B. dann, wenn sich die Diagnose einer ARVD mit anderen Methoden nicht sicher stellen läßt. Wenn die Diagnose nach den etwas später aufgeführten Kriterien eindeutig hat stellen lassen ist eine solche Untersuchung nicht notwendig.
Man gewinnt den Herzmuskel im Rahmen einer Rechtsherzkatheteruntersuchung mit einem speziellen Katheter. Hiermit entfernt man aus dem Inneren des rechten Ventrikels eine kleine Menge Muskelgewebe und untersucht dieses dann mikroskopisch. Man kann in solchen Gewebeproben sehen, daß der Herzmuskel durch Fettgewebe ersetzt wurde (Abb. 12).
Daneben sieht man aber auch vernarbte Anteile von Herzmuskel und Herzmuskelentzündungen.
Alles zusammen ergibt unter dem Mikroskop das typische Bild einer ARVD.
Die Biopsie kann natürlich nur dann wegweisende Ergebnisse haben, wenn auch Teile des erkrankten Herzmuskels erfaßt wurden. Dies ist aber vor allem in den frühen Stadien der ARVD nicht immer der Fall, weil hier oft nur kleine Inseln erkrankten Muskels vorliegen, die man mit der Zange des Biopsie-Katheters nicht trifft.
Die Untersuchung ist nicht ungefährlich, weil es zur Beschädigung von Herzklappen und deren Sehnenfäden kommen kann. Aber auch ein Durchbohren der Muskelwand des Herzens mit dem Auftreten einer Perikardtamponade ist möglich und nicht so selten. Daher wird diese Untersuchung nur unter bestimmten Bedingungen durchgeführt, z.B. wenn in der Familie des Betroffenen keine ARVD-Fälle bekannt sind bzw. vorliegen, wenn die genetische Untersuchung keine Auffälligkeiten zeigte oder wenn andere Erkrankungen ausgeschlossen werden müssen, die eine ARVD imitieren können.
Genetische Untersuchung
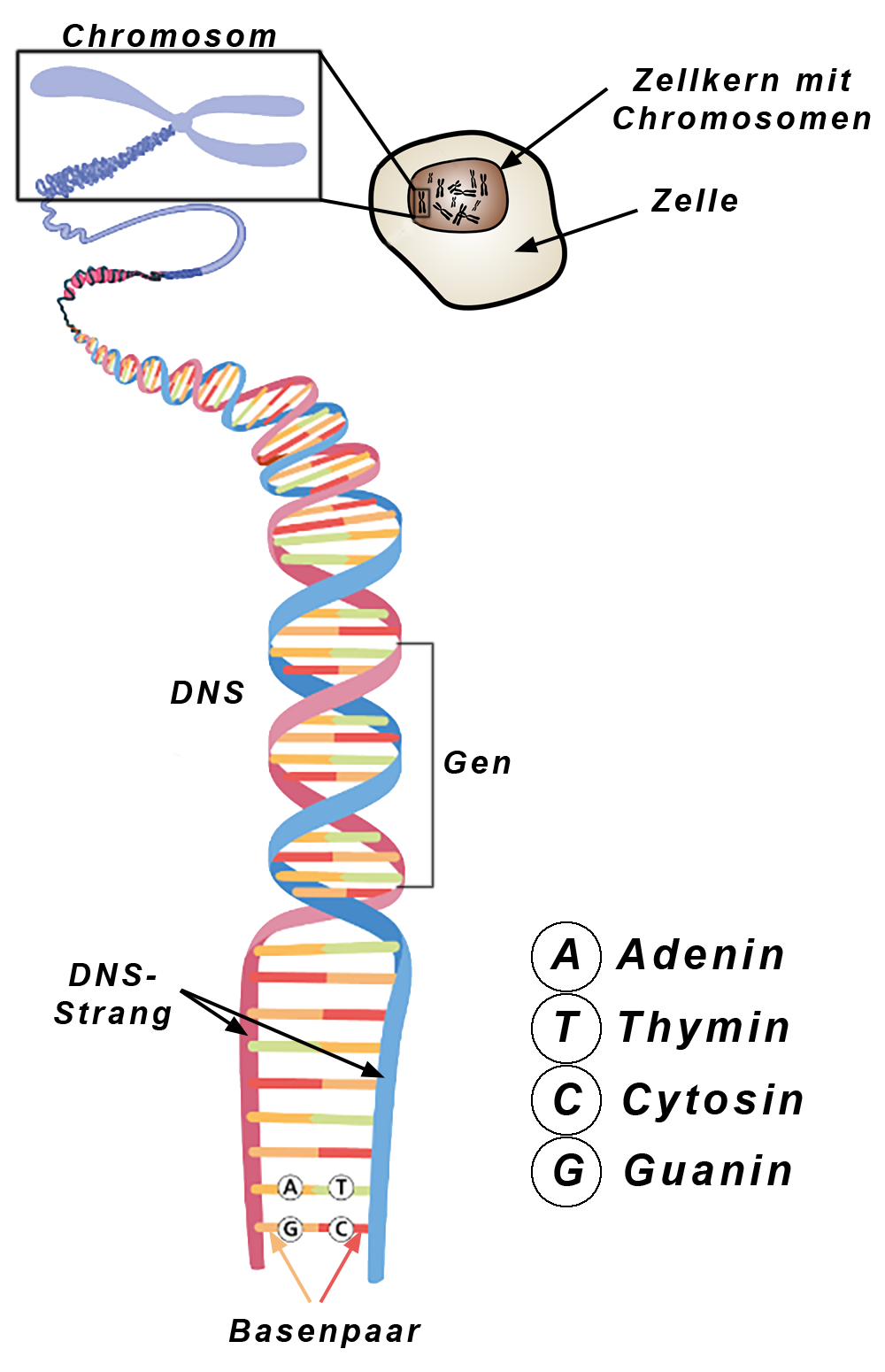 |
| Abb.13 |
Eine genetische Untersuchung ist kompliziert und damit zeitraubend und teuer. Sie eignet sich nicht für die Sofortdiagnostik, sondern wird nur eingesetzt, wenn die Diagnose einer ARVD mit den anderen Methoden nicht sicher ist.
Die genetische Untersuchung ist eine technisch sehr komplizierte Untersuchung. Sie basiert darauf, daß die gesamte Erbinformation in der DNS gespeichert ist, die sich wiederum in den insgesamt 23 Chromosomen des Menschen befindet (Abb. 13).
Die genetischen Informationen (Erbinformation) befinden sich im Zellkern einer Körperzelle auf den Chromosomen.
Diese bestehen aus 2 parallel verlaufenden DNS-Strängen (DNS-Doppelhelix). An einen DNS-Strang sind Aminosäuren (Adenin, Thymin, Cytosin und Guanin) in einer ganz bestimmten Reihenfolge gekoppelt. Der andere DNS-Strang ist spiegelbildlich aufgebaut.
Auch hier sind die genannten 4 Aminosäuren angekoppelt, die in Verbindung zu den jeweiligen Aminosäuren des 1. DNS-Strangs stehen. Dabei verbinden sich 1 Aminosäure des 1. Strangs immer nur mit einer bestimmten Aminosäure des 2. Strangs: Adenin ist immer mit Thymin und Guanin immer mit Cytosin verbunden.
Diese beiden miteinander verbundenen Aminosäuren bezeichnet man als „Basenpaar“.
Dieser Aufbau ermöglicht es, die Erbinformation bei einer Teilung der Zelle identisch auf den „neuen“ Chromosomensatz mit seinen DNS-Strängen zu übertragen, worauf ich in diesem Zusammenhang aber nicht weiter eingehen möchte.
 |
| Abb.14 |
| Anordnung der Basenpaare in gesunder und krankhafter DNS |
| Die Veränderung ist markiert |
Die eigentliche Erbinformation wird durch eine bestimmte Reihenfolge der Basenpaare in einem bestimmten Abschnitt der DNS-Stränge gespeichert. Diese Abschnitte sind die einzelnen Gene, die die Eigenschaften eines Menschen (oder Tieres) bestimmen. Es gibt beispielsweise Gene für die Haarfarbe, die Form der Hände, für die Gestalt von Herzklappen, für die Entstehung der roten Blutkörperchen oder (wichtig im Fall der ARVD) für die einzelnen Bestandteile der Desmosome.
An der Bildung des Desmosome sind 6 Gene beteiligt, von denen jedes krankhaft verändert sein kann. Die krankhafte Veränderung bezieht sich dabei darauf, daß die spezielle Reihenfolge in der Anordnung der Aminosäuren (= Nuklide) in diesem Gen verändert ist, d.h. daß die Reihenfolge der Aminosäuren an einem Strang nicht - Adenin - Thymin - Cytosin -, sondern - Adenin - Cytosin - Cytosin - lautet (Abb. 14).
Nach solchen Veränderungen gegenüber der normalen Erbinformation wird bei genetischen Untersuchungen, die auch DNS-Analyse genannt wird, gesucht.
Der Vorgang ist technisch sehr kompliziert und aufwendig und wird von den verschiedenen Laboren, die diese Test durchführen, technisch unterschiedlich durchgeführt. Daher möchte ich nachfolgend nur 1 der verschiedenen Methoden beschreiben:
Er besteht aus zahlreichen Schritten:
- Zunächst muß man Zellen mit ihren Zellkernen gewinnen. Dazu benutzt man Blut, das man aus einer Vene entnimmt, mit seinen weißen Blutkörperchen, man kann aber auch die Zellen aus einem Abstrich der Mundschleimhaut oder aus Haarbälgen benutzten.
- Aus diesem Material muß die DNS zunächst herausgelöst und abgesondert werden (DNS-Extraktion).
Dies erfolgt mit chemischen Substanzen, die die Oberflächenspannung von Flüssigkeiten vermindern (z.B. Spülmittel). Die chemischen Substanzen brechen dabei die Zellen und ihre Zellkerne auf, sodaß die DNS nun frei in der Flüssigkeit vorliegt.
Gibt man eiskalten Alkohol hinzu wird die sichtbar und kann nun aus der Flüssigkeit heraus-„gefiltert“ werden, sodaß sie weiter verarbeitet werden kann. Ich beschreibe nachfolgend die sog. Nanoporen-Sequenzierung, es gibt ab noch andere Methoden, die von Labor zu Labor unterschiedlich angewandt werden.
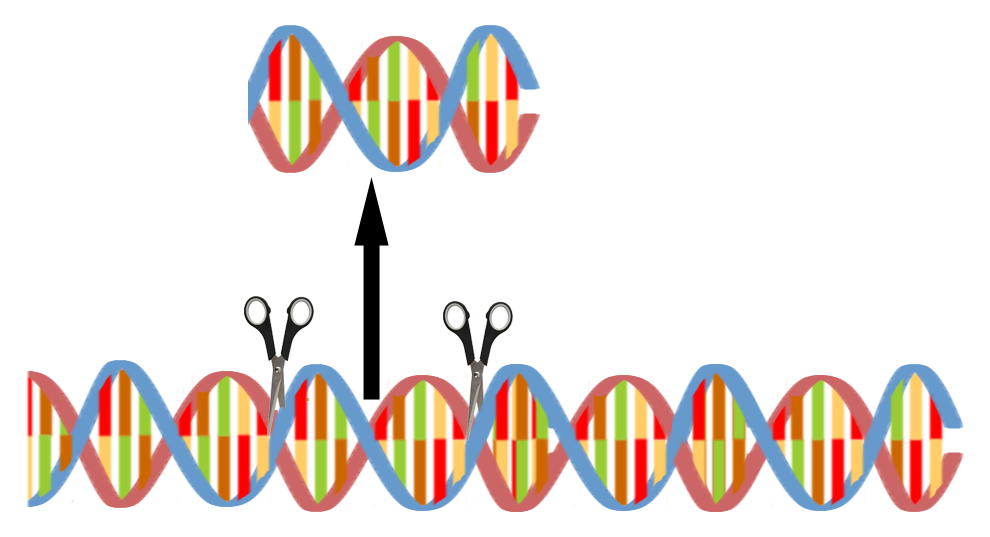
- Würde man die gesamte DNS untersuchen wollen würde die Analyse eine sehr sehr lange Zeit benötigen. Daher kann man den DNS-Strang mit Hilfe spezieller Enzyme, die als eine Art Schere arbeiten (= DNS-Fragmentierung) in Bruchstücke aufteilen.
Hierdurch entstehen Bruchstücke der DNS, von denen jedes 1 oder mehrere Gene enthält (Abb. 15) und deren Analyse sehr viel schneller erfolgen kann als die Untersuchung der DNS in ihrer gesamten Länge. Die Nanoporen-Sequenzierung erfolgt nun entweder an der gesamten DNS oder nur an den Bruchstücken.
- Für die Nanoporen-Sequenzierung benutzt man eine künstlich hergestellte Membran und ein spezielles Eiweißmolekül.
Dieses Eiweißmolekül besteht am Eingang aus Enzymen (= Enzymkopf), die die spiralige DNS-Doppelhelix aufwickelt, die die beiden DNS-Einzelstränge voneinander trennt, ggfs. (falls gewünscht) in Bruchstücke zerlegt, die den Beginn eines zu analysierenden Einzelstrangs erfaßt, die diesen Einzelstrang langsam in die Pore einführt und dann langsam hindurch transportiert (DNS-Motor in Abb. 16). Die einzelnen Nuklide wandern also langsam, Nuklid nach Nuklid, durch die Pore hindurch. Direkt unterhalb dieses Molekülkopfes beginnt ein feiner Kanal mit einem Durchmesser von 1/1.000 mm (=0,001 mm Nanopore), durch den der DNS-Strang hindurch transportiert wird. Wenn auf beiden Seiten der Membran eine elektrische Spannung gelegt wird dann hat dies zur Folge, daß durch die Pore nicht nur der DNS-Strang gezogen wird, sondern auch ein Strom in Gestalt elektrisch geladener Teilchen (= Ionen) fließt.
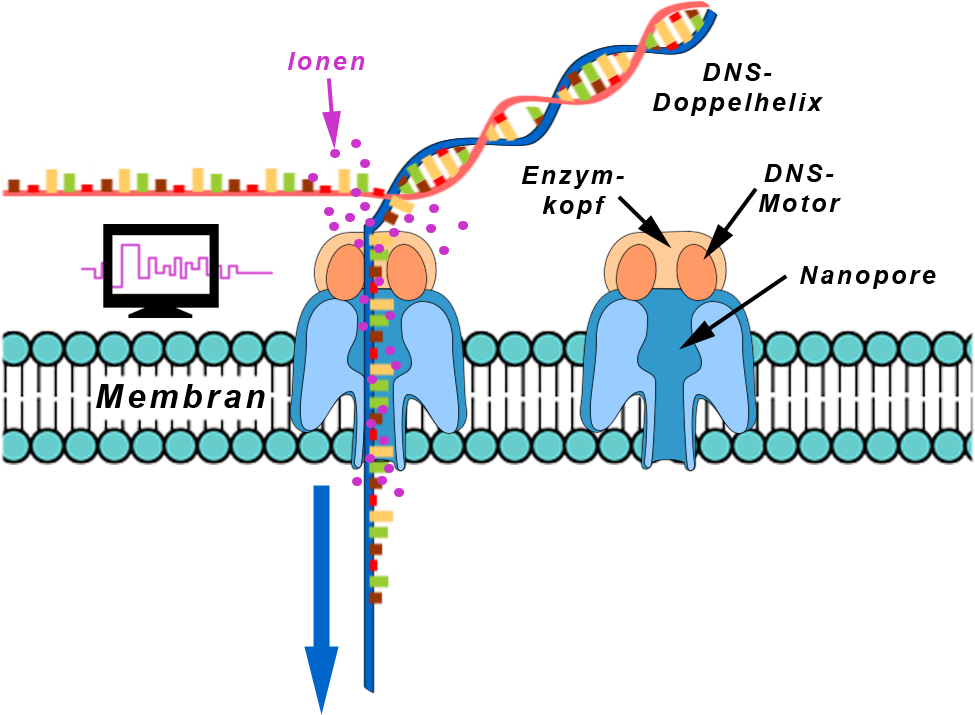
Abb.16 Nanoporen-Sequenzierung Erklärung siehe Text - Wenn nun der DNS-Strang durch die Nanopore gezogen wird dann kommt es durch jedes Nuklid, das sich gerade in ihr befindet, zu einer Änderung des Ionenstroms durch die Pore.
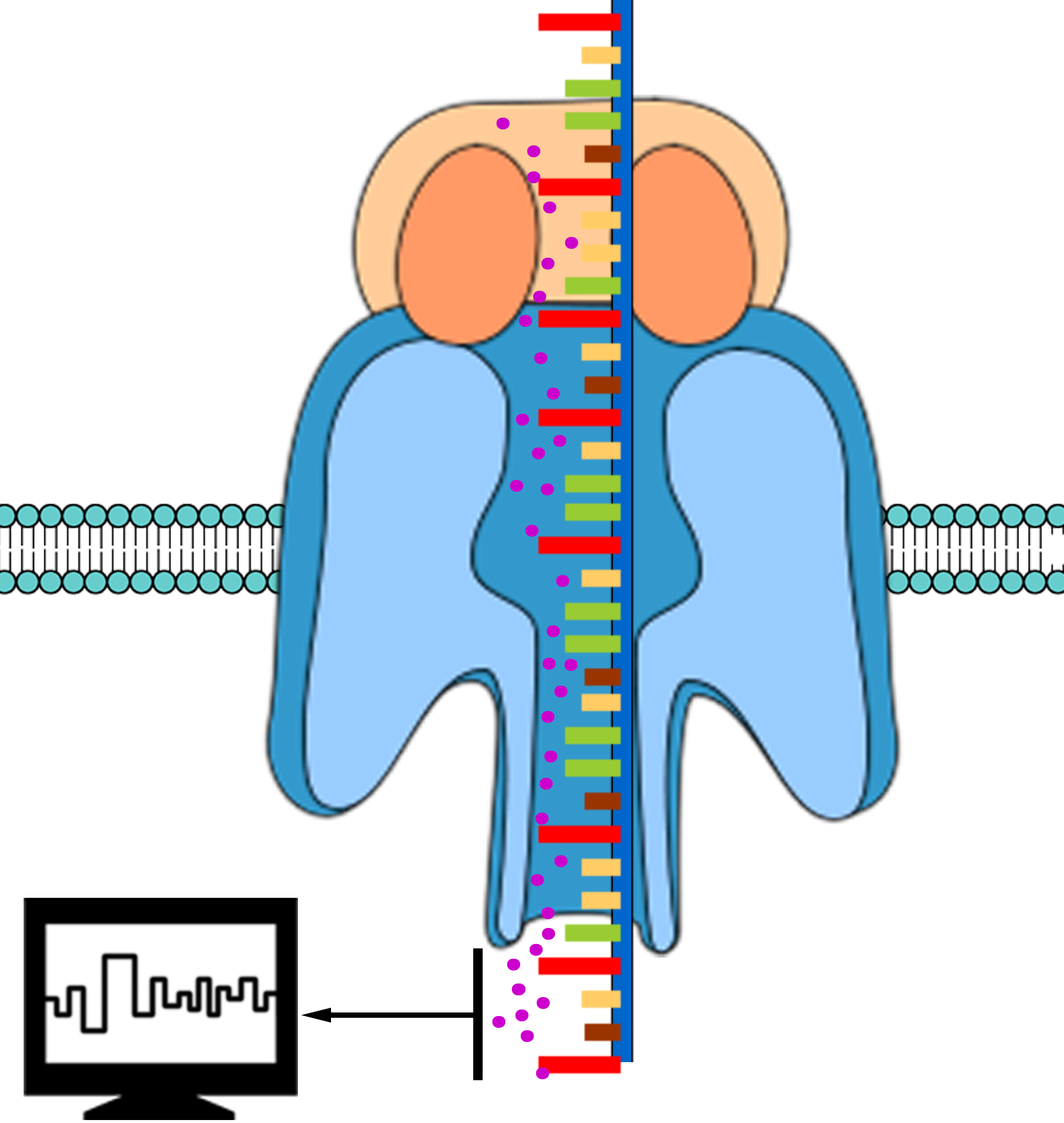
Abb.16 Nanoporen-Sequenzierung Erklärung siehe Text Diese Stromänderung ist charakteristisch für jedes Nuklid. Durch die Messung des Stroms kann man also die Abfolge, d.i. die Sequenz, der einzelnen Nuklide auf dem DNS-Strang erkennen (Abb. 17), weshalb, weshalb man das Verfahren auch Nanoporen-Sequenzierung nennt. Eine solche Nanoporen-Sequenzierung kann, je nach Umfang und Länge der zu untersuchenden DNS mehrere Tage bis zu einigen Wochen dauern.
 |
| Abb.15 |
| DNS-Fragmentierung |
| Erklärung siehe Text |
Neben dieser Nanoporen-Sequenzierung gibt es weitere technische Verfahren, wie z.B. die Pyro- oder die SANGER-Sequenzierung, die aber komplizierter sind und die vor allem eine längere Zeit zur Erfassung der Nuklid-Sequenz benötigen, weshalb ich an dieser Stelle nicht weiter darauf eingehen möchte.
Bei der arrhythmogenen rechtsventrikulären Dysplasie (ARVD) liegt eine genetisch bedingte Störung bei der Synthese derjenigen Eiweiße vor, aus denen Desmosomen bestehen. Diese genetischen Störungen werden durch Veränderungen einzelner Gene auf der DNS und der Nuklid-Reihenfolge in diesen DNS-Abschnitten hervorgerufen. Daher ist es sinnvoll, mit Hilfe genetischer Untersuchungen zu prüfen, ob die Nuklid-Reihenfolge in den einzelnen Genen normal oder verändert ist.
Man benutzt hierzu (wie schon erwähnt) eine Blutprobe, aus der die weißen Blutkörperchen abgetrennt und zur Gewinnung der DNS genutzt werden.
Es gibt 6 verschiedene bekannte Eiweißkomponenten, aus denen Desmosomen bestehen. Diejenigen Erbanlagen, die diese Eiweiße herstellen, deren Lage auf der DNS und die Nuklid-Reihenfolge in diesen Bereichen sind bekannt.
Mit Hilfe der DNS-Sequenzierung analysiert man die Gene eines Menschen mit möglicher ARVD und überprüft, ob es Abweichungen vom Normalzustand gibt.
Diagnose
Es gibt keine Untersuchungsmethode, anhand derer die Diagnose einer ARVD zweifelsfrei gestellt werden könnte, sondern es gibt „lediglich“ eine Reihe von Befunden, die für das Vorliegen der Krankheit sprechen könnten. Aus diesem Grund haben die großen kardiologischen Fachgesellschaften eine Liste von Kriterien und ein Bewertungssystem (= Score) erstellt, die für die Erstellung der ARVD-Diagnose hilfreich sind.
Für diesen Score benutzt man die Befunde aus 6 Kategorien, die danach bewertet werden, ob in der jeweiligen Kategorie ein Haupt-, ein Nebenkriterium oder keines der beiden vorliegt. Diese Kriterien sind:
- Bildgebung des rechten Ventrikels (Echokardiographie und/oder MRT): Gibt es Bewegungsstörungen seiner Wände oder eine Aussackung der Wand (Aneurysma), ist die Pumpfunktion des Ventrikels auf <45% vermindert?
- Gewebeproben (Myokardbiopsie): Sieht man unter dem Mikroskop mehr als 75% normale Herzmuskelzellen?
- EKG-Veränderungen: Besteht ein Rechtsschenkelblock oder sind die T-Wellen in welchen Ableitungen negativ?
- Liegt eine Epsilon-Welle vor?
- Herzrhythmusstörungen: Besteht eine ventrikuläre Tachykardie oder ist eine solche schon früher nachgewiesen worden?
- Sind im Langzeit-EKG mehr als 500 ventrikuläre Extraschläge während 24 Stunden gezählt worden?
- Familiengeschichte, genetische Untersuchung: Ist bei Eltern, Geschwistern oder weitläufigeren Verwandten eine ARVD gesichert festgestellt worden?
- Gibt es bei der genetischen Untersuchung des Betroffenen Auffälligkeiten bei den jeweiligen Genen?
- Ist 1 der Eltern oder ein Geschwisterteil schon jung (<35 Jahre) am plötzlichen Herztod gestorben?
Nach dieser Kriterienliste gilt die Erkrankung als
- gesichert, wenn 2 Hauptkriterien oder 1 Haupt- und 2 Nebenkriterien oder wenn 4 Nebenkriterien zutreffen
- möglich, wenn 1 Haupt- oder 2 Nebenkriterien zutreffen und
- denkbar, wenn 2 Hauptkriterien oder 1 Haupt- und 1 Nebenkriterium oder wenn 3 Nebenkriterien zutreffen.
Krankheiten mit ähnlichen Erscheinungen
Ähnliche Erscheinungen können die Vergrößerung und Pumpschwäche des rechten Ventrikels oder die bei der ARVD auftretenden bösartigen Herzrhythmusstörungen betreffen.
- Herzrhythmusstörungen:
- Grundsätzlich können viele Herzkrankheiten bösartige Herzrhythmusstörungen auslösen, z.B. Herzmuskelkrankheiten, koronare Herzkrankheit, Herzinfarkt o.ä.
- ventrikuläre Tachykardien können u.a. aus dem Ausflußteil des rechten Ventrikels stammen, auch ohne daß eine ARVD vorliegt
- BRUGADA-Syndrom: Siehe folgendes Kapitel
- Sarkoidose des Herzens (BOECK´sche Krankheit): Bildung bindegewebiger Knötchen in verschiedenen Organen und Geweben (z.B. in der Lunge)
- Vergrößerung bzw. Funktionsstörung des rechten Ventrikels:
- EBSTEIN-Anomalie: Angeborene Verlagerung der Tricuspidalklappe in Richtung auf den rechten Ventrikel
- UHL-Anomalie: Angeborene Verkümmerung des Muskels des rechten Ventrikels
- Angeborener Herzfehler mit Links-rechts-Shunt
- Angeborene Muskelerkrankungen (d.i. Muskeldystrophien)
- Myokarditis: Herzmuskelentzündung
- CHAGAS-Krankheit: Infektionskrankheit, meistens in Südamerika auftretend, wird durch Wanzen übertragen
Komplikationen
Komplikationen können auftreten, wenn die Erkrankung nicht festgestellt oder unzureichend behandelt wird. Zu den Komplikationen gehören:
- Ventrikuläre Tachykardie
- Kammerflimmern mit plötzlichem Herztod
- Lungenembolie infolge einer Gerinnselbildung im vergrößerten und müde pumpenden rechten Ventrikel
- Schwächung des rechten Ventrikels (Rechtsherzinsuffizienz)
Komplikationen können natürlich auch infolge der Behandlung (siehe unten) und der Untersuchungsmethoden auftreten.
Notfälle
Alle unter den Komplikationen genannten Ereignisse.
Vorbeugende Maßnahmen
Keine.
Faktoren, die das Risiko erhöhen, im Laufe des Lebens zu erkranken
Keine.
Verhaltensweisen, die die Heilung fördern
Eine Heilung dieser erkrankung ist nicht möglich, weil sie angeboren ist und auf einer Veränderung der Gene beruht. Man kann lediglich etwas tun, um das Auftreten von Komplikationen und das Fortschreiten der Herzmuskelermüdung zu verlangsamen:
Wichtig ist in diesem Zusammenhang die Vermeidung stärkerer körperlicher Aktivitäten, weil solche Aktivitäten bösartige Herzrhythmusstörungen auslösen können und das Fortschreiten der Pumpschwäche des rechten Ventrikels fördern. Diesbezüglich wird empfohlen, täglich nicht mehr als 30 min forsch zu gehen.
Verhaltensweisen, die die Krankheit verschlimmern
Stärkere körperliche Belastungen begünstigen das Auftreten bösartiger Herzrhythmusstörungen und das Fortschreiten der Herzmuskelermüdung.
Therapie
Die Behandlung zielt darauf ab,
- das Risiko eines plötzlichen Herztodes zu vermindern,
- den Verlauf der Erkrankung im Hinblick auf eine zunehmende Pumpschwäche des rechten Ventrikels zu verlangsamen und
- die Lebensqualität zu verbessern, indem Herzstolpern durch Herzrhythmusstörungen sowie die Beschwerden einer Herzschwäche vermindert werden.
Zu den Behandlungsmaßnahmen gehören:
Lebensstil
Dies bezieht sich auf die Vermeidung körperlicher Aktivitäten (siehe oben).
Medikamentenbehandlung
Medikamente werden eingesetzt, um das Auftreten von Herzrhythmusstörungen zu vermindern, die Entstehung von Blutgerinnseln im rechten Ventrikel zu verhindern und das Fortschreiten der Rechtsherzschwäche aufzuhalten und deren Beschwerden zu lindern.
Medikamente gegen Herzrhythmusstörungen werden eingesetzt, um das Auftreten bösartiger Herzrhythmusstörungen, die zur Auslösung eines Elektroschocks des ICDs führen, zu verhindern. Eingesetzt werden:
- beta-Blocker zur Unterdrückung von Herzrhythmusstörungen und zur Behandlung einer Herzschwäche
- Sotalol, bei dem es sich um einen speziellen beta-Blocker mit zusätzlicher Wirkung gegen Herzrhythmusstörungen handelt. Sotalol ist das effektivste Medikament zur Behandlung von Herzrhythmusstörungen bei der ARVD.
- Antiarrhythmika (Medikamente gegen Herzrhythmusstörungen), z.B. Amiodarone oder Flecainid. Ihr Risiko besteht allerdings darin, ein long-QT-Syndrom (siehe eines der folgenden Kapitel) auslösen zu können.
- Zur Behandlung der Herzschwäche ACE-Hemmer, AT1-Blocker und entwässernde Medikamente (Diuretika)
- Medikamente zur Blutgerinnungshemmung werden nur bei Patienten eingesetzt, die die Herzrhythmusstörung Vorhofflimmern haben oder bei denen eine Embolie aufgetreten ist.
Katheterablation
Wenn es bei einer elektrophysiologischen Untersuchung möglich gewesen sein sollte, den Ausgangspunkt der Herzrhythmusstörungen klar zu lokalisieren kann man versuchen, diesen Punkt durch einen elektrischen Stromstoß, durch punktuelle Kälte- oder Wärmeanwendung an der Spitze eines speziellen Katheters zu veröden.
Angewandt wird diese Behandlung immer dann, wenn ein ICD (siehe unten) implantiert wurde und dennoch ventrikuläre Tachykardien auftreten. Dennoch können auch nach einer Katheterablation dennoch ventrikuläre Tachykardien auftreten (50 - 75% aller betroffenen Menschen während 3 Jahren).
Implantation eines automatischen Defibrillators (ICD)
Für genauere Informationen über eine ICD-Behandlung hier klicken.
Diese Behandlung ist zur Verhinderung des plötzlichen Herztodes die effektive Methode. Eingepflanzt werden sollten sie
- wenn der Patient schon einmal einen Herzstillstand aufgrund einer bösartigen Herzrhythmusstörung hatte und einen plötzlichen Herztod überlebt hat
- wenn es zu ventrikulären Tachykardien (auch ohne hierdurch ausgelöste Ohnmacht oder Kreislaufstillstand) gekommen ist und diese Tachykardien durch eine medikamentöse Behandlung nicht unterdrückt werden konnte
- wenn eine ventrikuläre Tachykardie bei einer elektrophysiologischen Untersuchung künstlich ausgelöst werden kann
- wenn rechter oder linker Ventrikel nur noch stark geschwächt pumpen und es für das Herz daher schwer ist, auch leichtere (d.i. langsamere) Formen einer ventrikulären Tachykardie zu tolerieren oder
- wenn ein naher Verwandten (Eltern, Geschwister) am plötzlichen Herztod gestorben ist.
Obwohl ein ICD die wirksamste Behandlungsform einer ARVD ist muß man dennoch berücksichtigen, daß es in etwa 4% aller ICD-Patienten zu Komplikationen wie z.B. Entzündungen der Elektroden, das Verrutschen der Elektroden oder zu fehlerhaft ausgelösten Elektroschocks kommen kann.
Herztransplantation
Eine Herztransplantation ist eine Behandlung, die nur dann erwogen wird, wenn es mit allen anderen oben genannten Verfahren nicht gelingt, die ventrikulären Tachykardien zu beseitigen bzw. sie deutlich zu vermindern oder wenn die Pumpschwäche des Herzens trotz ausreichender medikamentöser Behandlung fortschreitet.
Die Erfolgsaussichten einer Herztransplantation sind gut, nach 5 Jahren leben noch etwa 80% aller transplantierten Menschen.
Wann muß der Hausarzt aufgesucht werden
Immer dann, wenn eine plötzliche Ohnmacht aufgetreten ist muß der Hausarzt aufgesucht werden, um zunächst orientierend zu untersuchen, ob es sich dabei um eine durch Rhythmusstörungen bedingt Ohnmacht gehandelt hat. Ggfs. muß schon zu diesem Zeitpunkt ein Kardiologe eingeschaltet werden.
Dies gilt natürlich auch für denjenigen Fall, in dem ein Patient über Herzklopfen und Herzrasen klagte und dann im EKG, Langzeit-EKG oder mit einem Ereignis-Rekorder (z.B. einer smartWatch) stark gehäufte Extrasystolen, salvenartig auftretende Herzrhythmusstörungen oder sogar ventrikuläre Tachykardien aufgezeichnet wurden.
- Patienten, bei denen frühere Untersuchungen ergeben haben, daß eine ARVD möglich oder denkbar ist (siehe Diagnosekriterien in vorherigem Kapitel) sollten jährlich u.a. mit einem Langzeit-EKG und einem Echokardiogramm untersucht werden, um zu prüfen, ob sich zwischenzeitlich etwas geändert hat. So muß bei solchen Patienten z.B. durch den Nachweis stark gehäufter ventrikulärer Extrasystolen oder bei einer Vergrößerung und Pumpschwäche des rechten Ventrikels befürchtet werden, daß die die Diagnose einer ARVD nicht länger möglich oder denkbar, sondern jetzt gesichert ist.
- Patienten mit einer bekannten ARVD, die aber ohne Beschwerden sind, sollten (auch bei beschwerdefreiem Verlauf) alle 1 - 2 Jahre kontrolliert werden.
- Bei Patienten mit bekannter ARVD, die mit Antiarrhythmika medikamentös behandelt werden, müssen regelmäßige EKG-Kontrollen erfolgen, um eine Verlängerung der QT-Zeit (siehe eines der folgenden Kapitel) auszuschließen. Solche EKG-Kontrollen sind natürlich bei allen Patienten unter Antiarrhythmika erforderlich, wenn sie andere Medikamente einnehmen, die die QT-Zeit ebenfalls verlängern können.
Bei jeder dieser Kontrollen muß der Patient über das Wesen seiner Erkrankung und über evtl. Warnsymptome (Herzklopfen, Herzrasen, Schwindel oder Ohnmacht) informiert werden.
Jeder ARVD-Patient sollte daran erinnert werden, keine stärkeren körperlichen Belastung, keinen Kraftsport (z.B. Gewichtheben oder Hanteltraining) zu betreiben und nicht an Sportwettkämpfen teilzunehmen.
Auch sollte der Patient darüber informiert werden, daß auch seine Familienangehörigen daraufhin untersucht werden sollten, ob sie nicht vielleicht auch von der Krankheit betroffen sind.
BRUGADA-Syndrom
Das BRUGADA-Syndrom ist nach seinen Entdeckern, den Brüdern Brugada benannt, die 1992 acht Patienten beschrieben, die nach einem Herzstillstand erfolgreich wiederbelebt worden waren. Sie alle zeigten eine bestimmte Auffälligkeit im EKG.
Es handelt sich um eine Ionenkanalerkrankung, bei der eine elektrische Störung der Herzfunktion ohne erkennbare strukturelle Herzerkrankung vorliegt. Dadurch können lebensgefährliche Herzrhythmusstörungen auftreten. Das erste Symptom des BRUGADA-Syndroms kann Schwindel, ein kurzzeitiger Bewußtseinsverlust (Synkope) oder ein Herzstillstand sein.
Beschreibung der Erkrankung
Das BRUGADA-Syndrom wird durch eine Funktionsstörung eines Ionenkanals verursacht, die zu einer Störung des Ionenflusses durch die Zellmembran der Herzmuskelzellen und damit zu einer Veränderung des Aktionspotentials der betroffenen Zellen führt. Über die elektrische Aktivität einer Zellmembran (Membran-Ruhe- und -Aktionspotential) hatte ich schon in Band 3 dieser eBook-Reihe der Patienten-Akademie über die Anatomie des Herzens berichtet. Daher hier nur eine Zusammenfassung:
Zwischen dem Inneren und dem Äußeren einer Zelle besteht eine elektrische Spannungsdifferenz (Membran-Ruhe-Potential). Diese Spannungsdifferenz entsteht dadurch, daß sich im Inneren einer Zelle eine andere Häufung elektrisch geladener Teilchen (= Ionen) befindet als außerhalb der Zellen. So befinden sich innerhalb der Zelle sehr viel mehr elektrisch positiv geladene Kalium-Ionen als außerhalb, während sich außerhalb der Zelle sehr viel mehr ebenfalls positiv geladene Natrium-Ionen befinden.
Da im Inneren einer Herzmuskelzelle weniger positiv geladene Ionen vorhanden sind als außerhalb der Zelle ist das Zellinnere gegenüber dem Zelläußeren negativ geladen und zwar um 60 - 100 mV (milliVolt). Diese Spannungsdifferenz bezeichnet man als Ruhe-Potential. Wenn eine Zelle nun elektrisch erregt .......
Ende der Leseprobe
Lesen Sie in den eBooks (padBook, phoneBook, Kindle) mehr über:
- das BRUGADA-Syndrom
- das QT-Syndrom und
- das WPW-Syndrom.
Zu jedem Thema finden Sie jeweils Abschnitte über
- Art der Erkrankung
- ihre Einteilung und Ursache die Krankheitserscheinungen
- Untersuchungsmethoden, mit denen die Erkrankung untersucht wird wie
- EKG
- Röntgen
- evtl. Herzgeräusche
- Echokardiographie
- Kardio-CT Kardio-MRT
- Herzkatheteruntersuchung
- evtl. Biopsie
- elektrophysiologische Untersuchung
- Krankheiten mit ähnlichen Erscheinungen
- Komplikationen
- Notfälle
- vorbeugende Maßnahmen
- Risikofaktoren
- was die Heilung fördert
- was die Krankheit verschlimmert
- die Therapie und
- wann der Hausarzt aufgesucht werden sollte.
Sie können Band 25 dieser eBook-Reihe bekommen, wenn Sie hier klicken:
- padBook (für iPad und epub3-fähige eBook-Reader)
- phoneBook (für smartPhones)
- Paperwhite (für Kindle Paperwhite)